Васкулит (воспаление сосудов) в детском возрасте может быть как идиопатическим, так и результатом действия известных антигенов (например, инфекционных агентов или лекарственных средств, вызывающих аллергические реакции). Васкулитом сопровождаются и многие аутоиммунные заболевания. Степень поражения сосудов может быть от умеренной, как в большинстве случаев геморрагического васкулита, до тяжелой, как у детей с узелковым полиартериитом.
Большинство классифицации системных васкулитов учитывает размеры локализацию пораженных сосудов, а также характер воспалительного инфильтрата. Поражаться могут как крупные сосуды (аортоартериит), так и капилляры и артериолы, что характерно для ювенильного дерматомиозита. Воспалительные инфильтраты могут содержать различные количества нейтрофилов, лимфоцитов и эозинофилов. Ключевую роль в патогенезе многих системных васкулитов играют иммунные комплексы.
Они активируют комплемент, освобождая его хемотаксические компоненты (С3а, С5а), которые привлекают воспалительные клетки. Предполагается, что имунные комплексы, связываясь с клетками эндотелия, увеличивают синтез и экспрессию на их поверхности молекул адгезии. Последние связываются с другими молекулами адгезии на поверхности нейтрофилов, привлеченных хемотаксическими факторами. Это приводит к выделению из лейкоцитов лизосомных ферментов, которые разрушают клеточный матрикс сосудов и окружающих тканей. В процессе дегрануляции нейтрофилов они могут распадаться с образованием «ядерной пыли» — характерного признака лейкокластического васкулита.

Признаки и симптомы системных васкулитов неспецифичны. Однако некоторые проявления позволяют определить тип первично пораженных сосудов. Пальпируемая пурпура свидетельствует о воспалении мелких сосудов, расположенных в глубине сосочкового слоя дермы, тогда как округлые болезненные узелки более характерны для поражения сосудов среднего размера.
Геморрагический васкулит (ранее называемый анафилактоидной пурпурой) — воспаление мелких сосудов. Именно это заболевание является наиболее частой причиной кровоточивости, не связанной с тромбоцитопенией.
Причина геморрагического васкулита неизвестна, но обычно он развивается после инфекции верхних дыхательных путей. Оценки распространенности этого состояния (9 на 100 000 населения), по-видимому, занижены, поскольку многие случаи заболевания не регистрируются. Однако из 31 333 больных, наблюдавшихся в 54 детских ревматологических центрах США, у 1120 имелась та или иная форма васкулита, у 558 был геморрагический васкулит. Раньше на долю геморрагического васкулита приходился 1 % госпитализаций, но улучшение методов терапии привело к значительному снижению этого показателя.
По данным одного из крупных педиатрических центров США, в 1997 г. доля больных с геморрагическим васкулитом составила 0,06% (62 из 9083) от всех госпитализированных детей. Это заболевание встречается у детей чаще, чем у взрослых. Пик заболеваемости приходится на возраст от 2 до 8 лет (обычно в зимнее время). Мальчики заболевают в 2 раза чаще девочек.
У больных геморрагическим васкулитом значительно повышена встречаемость антигена HLA-DRB1*07. В активной стадии заболевания возрастает концентрация ФНО-а и ИЛ-6. По данным одного из исследований, почти у 50 % больных повышен титр антистрептолизина О, что указывает на роль стрептококков группы А. С гистологической точки зрения геморрагический васкулит представляет собой опосредованное IgG воспаление мелких сосудов. Иммунофлюоресцентными методами обнаруживаются отложения IgA и С3 в стенках мелких сосудов кожи и почечных клубочков, но роль активации комплемента признается не всеми исследователями.
О.Г. КРИВОШЕЕВ, доцент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук; С.В. ГУЛЯЕВ, ассистент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук

Пурпура Шенлейна—Геноха (геморрагический васкулит) — системный васкулит, поражающий микроциркуляторное русло (артериолы, капилляры и посткапиллярные венулы), с типичным отложением в стенке сосудов иммунных комплексов, состоящих из иммуноглобулинов А (IgA). Клинически болезнь проявляется кожной геморрагической сыпью, суставным синдромом, поражением желудочно-кишечного тракта (ЖКТ) и почек.
Пурпура Шенлейна—Геноха развивается в любом возрасте, однако максимальная заболеваемость наблюдается у детей в возрасте 4—6?лет, составляя примерно 13—18 случаев на 100 тыс. С возрастом заболеваемость снижается и развитие болезни после 60 лет считается редкостью.
Этиология заболевания не установлена, однако увеличение частоты развития пурпуры Шенлейна—Геноха в холодное время года, а также нередкая связь дебюта болезни с эпизодами острой респираторной или кишечной инфекции могут косвенно свидетельствовать об инфекционной природе заболевания. В список этиологических агентов, ассоциирующихся с развитием пурпуры Шенлейна—Геноха, входят ?-гемолитический стрептококк группы А, гемофильная палочка, хламидии, микоплазмы, легионеллы, иерсинии, вирусы Эпштейна—Барр, Коксаки, гепатита В и С, аденовирус, цитомегаловирус, парвовирус В19, сальмонеллы, Helicobacter pylori, Clostridium difficile. Имеются единичные наблюдения пурпуры Шенлейна—Геноха, развившейся после проведения вакцинации против брюшного тифа, кори, гриппа. В качестве триггеров заболевания могут выступать алкоголь, лекарства, пищевые продукты, переохлаждение, укусы насекомых.
Патогенез
В настоящее время пурпура Шенлейна—Геноха рассматривается как иммунокомплексное заболевание, связанное с отложением в сосудистой стенке гранулярных IgA-депозитов и активацией комплемента. Эта концепция основывается на результатах многочисленных исследований, показавших нарушение синтеза и/или метаболизма IgA у большинства больных пурпурой Шенлейна—Геноха: повышение уровня сывороточного IgA, IgA-содержащих иммунных, а также IgA-фибронектиновых комплексов. Тем не менее патогенетическое значение этих нарушений требует дальнейшей оценки. В последние годы накапливаются факты, свидетельствующие о противовоспалительных свойствах IgA, что дает основание расценивать увеличение его синтеза как компенсаторный процесс, возникающий вторично в ответ на воспалительную реакцию в слизистых оболочках. Так, было показано, что IgA обладает способностью уменьшать продукцию провоспалительных цитокинов и не способен активировать комплемент; IgA обнаруживается в эндотелии непораженных сосудов и в мезангии неизмененных почечных клубочков; описано наблюдение пурпуры Шенлейна—Геноха при полном селективном дефиците IgA. Учитывая нередкую связь развития пурпуры Шенлейна—Геноха с эпизодами инфекций респираторного тракта и ЖКТ, это предположение представляется вполне вероятным.
Другой причиной изменений в метаболизме IgA при пурпуре Шенлейна—Геноха может быть нарушение О-гликозилирования шарнирной области тяжелых цепей молекулы IgA1, что, как было показано, может приводить к нарушению клиренса IgA1 рецепторами печени и удлинению периода циркуляции IgA-полимеров и IgA-содержащих иммунных комплексов в системном кровотоке. Показано, что молекулы IgA1 с аберрантным гликозилированием приобретают способность активировать комплемент по альтернативному пути и имеют повышенную тропность к мезангиальному матриксу почечных клубочков.
В последние годы получены дополнительные данные, косвенно подтверждающие предположение об инфекционно зависимом характере пурпуры Шенлейна—Геноха. Так, было показано, что у большинства больных в период обострения кожного васкулита наблюдается транзиторная эндотоксемия — циркуляция в системном кровотоке липополисахарида грамотрицательных бактерий. Патогенетическое значение этого феномена при пурпуре Шенлейна—Геноха требует дальнейшего изучения, однако предполагается возможность участия эндотоксина в развитии сосудистого воспаления, опосредованного реакцией Шварцмана. Важную роль в патогенезе эндотоксемии может играть хроническое воспаление кишечной стенки, возможно, обусловленное дисфункцией ее локальной иммунной системы или инфекционным процессом. В пользу этого предположения свидетельствует обнаружение повышенной кишечной проницаемости для макромолекул (овальбумин) у большинства больных пурпурой Шенлейна—Геноха в период обострений кожного васкулита. Кроме этого продемонстрировано наличие у больных пурпурой Шенлейна—Геноха хронического воспалительного процесса в слизистой оболочке тонкой кишки, что, по-видимому, является морфологической основой для нарушения функции кишечного барьера и развития транзиторной эндотоксемии.
Клиническая картина
Клиническая картина пурпуры Шенлейна—Геноха складывается из четырех типичных проявлений: кожной геморрагической сыпи, поражения суставов, ЖКТ и почек. В большинстве случаев болезнь развивается исподволь, постепенно и существенно не нарушает общее состояние больных. Как правило, такой вариант начала болезни наблюдается при изолированном поражении кожи. Количество органных проявлений пурпуры Шенлейна—Геноха варьирует от 1—2 до комбинации всех 4 классических признаков, которые могут развиваться в любой последовательности в течение нескольких дней или недель болезни. В некоторых случаях, кроме упомянутых проявлений, может развиваться поражение других органов, в частности, легких, сердца, центральной нервной системы.
Поражение кожи наблюдается у всех больных пурпурой Шенлейна—Геноха и является обязательным критерием диагностики. В большинстве случаев геморрагическая сыпь является первым клиническим проявлением болезни, к которому в дальнейшем присоединяется поражение других органов и систем. Наиболее типичная локализация кожных высыпаний: нижние конечности — голени и стопы. Нередко кожная сыпь распространяется на бедра, ягодицы, туловище, верхние конечности и исключительно редко на лицо. В процессе эволюции геморрагии постепенно бледнеют, трансформируются в коричневые пигментные пятна и затем исчезают. При длительном рецидивирующем течении кожа в области поражения может пигментироваться вследствие развития гемосидероза. В большинстве случаев геморрагическая сыпь представлена петехиями и пурпурой, однако в ряде случаев могут также наблюдаться эритематозно-макулярные и уртикарные элементы.
Поражение суставов, как правило, развивается параллельно с поражением кожи и протекает по типу мигрирующих полиартралгий, реже — артритов. Излюбленная локализация — коленные и голеностопные суставы, реже поражаются локтевые, лучезапястные и другие суставы. Эти проявления болезни всегда преходящи и доброкачественны, никогда не приводят к развитию стойких изменений в суставах.
Поражение ЖКТ отмечается у 60—80% больных детского возраста и у 40—65% взрослых больных. Наиболее постоянный симптом: боли в животе, усиливающиеся после еды, что нередко создает типичную картину «брюшной жабы». Частым осложнением абдоминального поражения при пурпуре Шенлейна—Геноха является кишечное кровотечение.
Поражение почек при пурпуре Шенлейна—Геноха может приобретать хроническое течение и является главным фактором, определяющим прогноз болезни в целом. Частота вовлечения почек варьирует от 30 до 70% в зависимости от возраста больных. У взрослых поражение почек выявляется почти в 2 раза чаще, чем у детей. Как правило, клинические признаки поражения почек выявляют в первые 3 месяца заболевания, тем не менее при хроническом рецидивирующем течении кожного васкулита возможно отсроченное возникновение признаков гломерулонефрита — спустя несколько месяцев или даже лет после дебюта болезни. Возможными предвестниками вовлечения в процесс почек у детей являются мужской пол, возраст старше 5 лет, абдоминальный синдром, персистирующая кожная пурпура и снижение уровня фактора XIII в плазме крови. У взрослых больных к факторам риска поражения почек относят наличие лихорадки и эпизоды инфекций в дебюте болезни, распространение кожной сыпи на туловище, тяжелый абдоминальный синдром и наличие лабораторных признаков воспалительной активности болезни. Тяжесть почечной патологии, как правило, не коррелирует с выраженностью кожных проявлений болезни, однако как у детей, так и у взрослых отмечена достоверная положительная корреляция между частотой поражения почек и развитием абдоминального синдрома, что требует более тщательного динамического наблюдения за соответствующим контингентом больных. У детей в половине случаев поражение почек имеет благоприятное течение с полным клинико-лабораторным выздоровлением, в то время как у большинства взрослых больных наблюдается тенденция к хроническому персистирующему течению нефрита.
У половины больных пурпурой Шенлейна—Геноха гломерулонефрит проявляется микрогематурией, которая, как правило, сочетается с минимальной или умеренно выраженной протеинурией. У трети больных наблюдается макрогематурия, которая чаще всего развивается в дебюте нефрита, но может возникать и на более поздних этапах почечного поражения во время обострений кожного васкулита или респираторных инфекций. Возможны и более тяжелые варианты почечного поражения, в том числе нефротический синдром, быстропрогрессирующий нефрит и острая почечная недостаточность. У 14—20% больных обнаруживается синдром артериальной гипертензии. Развитие хронической почечной недостаточности (ХПН) в исходе гломерулонефрита отмечается у 12—30% больных.
Диагностика
Диагностика пурпуры Шенлейна—Геноха основывается на выявлении типичных клинических признаков заболевания, в первую очередь двусторонних кожных геморрагических высыпаний в момент осмотра или в анамнезе. Специфических лабораторных тестов при пурпуре Шенлейна—Геноха не существует. Изменения в клиническом анализе крови — повышение скорости оседания эритроцитов (СОЭ) — могут отражать воспалительную активность болезни, а также выраженность осложнений (анемия при кишечном кровотечении). Наличие тромбоцитопении — критерий исключения пурпуры Шенлейна—Геноха. Выраженное повышение СОЭ и значительная диспротеинемия не характерны для пурпуры Шенлейна—Геноха. Активность болезни отражают уровень фактора Виллебранда и тромбомодулина в плазме крови. Обнаружение высокого уровня продуктов деградации фибрина/фибриногена в плазме при активных формах болезни не является признаком развития ДВС-синдрома, а лишь отражает высокую воспалительную активность заболевания. В план обследования всех больных необходимо включать вирусологическое и иммунологическое исследование крови для исключения других заболеваний, протекающих с кожной пурпурой.
Ключевую роль в подтверждении клинического диагноза играет биопсия кожи и/или почек, реже других органов, с обязательным проведением иммуногистохимического исследования, выявляющего фиксацию в сосудистой стенке IgA-содержащих иммунных комплексов. Следует учитывать, что кроме пурпуры Шенлейна—Геноха, IgA-депозиты обнаруживают при поражении кожи в рамках хронических воспалительных заболеваний кишечника (болезнь Крона, язвенный колит), хронических диффузных заболеваний печени алкогольной этиологии, целиакии, герпетиформного дерматита Дюринга.
Морфологическая картина поражения почек при пурпуре Шенлейна—Геноха идентична таковой при болезни Берже (первичной IgA нефропатии). Наиболее частый морфологический вариант поражения почек — мезангиопролиферативный гломерулонефрит, характеризующийся фокальной или диффузной пролиферацией мезангиоцитов. Иммуногистохимическое исследование выявляет гранулярные депозиты IgA, реже IgG, а также С3-компонента комплемента, фибрина. В более тяжелых случаях отмечается формирование эпителиальных «полулуний».
Широко используемые классификационные диагностические критерии пурпуры Шенлейна—Геноха, предложенные в 1990?г. Американской коллегией ревматологов и включающие возраст больного менее 20 лет, пальпируемую пурпуру, абдоминальный синдром и морфологическую картину кожного лейкоцитокластического васкулита (необходимо наличие 2 и более из 4 критериев), имеют малую практическую значимость вследствие их низкой чувствительности и специфичности (87,1 и 87,7%, соответственно).
Дифференциальная диагностика
Дифференциальная диагностика проводится с широким кругом заболеваний, протекающих с поражением сосудов мелкого калибра:
- первичные васкулиты сосудов мелкого калибра (гранулематоз Вегенера, микроскопический полиангиит, синдром Черджа–Стросс, криоглобулинемический васкулит). Дифференциально-диагностическое значение имеют результаты исследования крови на антинейтрофильные цитоплазматические антитела (гранулематоз Вегенера, микроскопический полиангиит, синдром Черджа–Стросс) и криоглобулины (криоглобулинемический васкулит); данные морфологического исследования (гранулематозное воспаление при гранулематозе Вегенера, эозинофильный васкулит при синдроме Черджа—Стросс). Особое значение имеет иммуногистохимическое исследование биоптатов пораженных тканей. Обнаружение IgA-депозитов является характерным признаком пурпуры Шенлейна—Геноха.
- Васкулиты при аутоиммунных заболеваниях (системной красной волчанке, ревматоидном артрите, болезни Шегрена, болезни Крона, язвенном колите). Дифференциация основывается на клинических особенностях, свойственных каждой нозологии, результатах лабораторно-инструментальных методов исследования.
- Васкулиты при инфекциях (подострый инфекционный эндокардит, туберкулез, инфекция вирусами гепатита В и С), злокачественных новообразованиях, лекарственной аллергии.
При поражении кожи могут быть эффективны такие лекарственные средства группы сульфаниламидов: сульфасалазин (внутрь по 500—1000 мг 2 раза в сутки), колхицин (внутрь, 1—2 мг 1 раз в сутки). Глюкокортикоиды эффективны у подавляющего числа больных, особенно в высоких дозах, однако их длительное применение у больных пурпурой Шенлейна—Геноха без вовлечения внутренних органов нежелательно, поскольку выраженность побочных эффектов в такой ситуации может превосходить тяжесть самой болезни. Назначение нестероидных противовоспалительных препаратов (НПВП) оправдано лишь при выраженном суставном синдроме и неэффективности других лекарственных средств. В остальных случаях от назначения НПВП следует воздерживаться вследствие неблагоприятного действия на слизистую оболочку кишечника и усиления кишечной проницаемости.
Поражение желудочно-кишечного тракта с интенсивными абдоминалгиями — абсолютное показание к назначению глюкокортикоидов:
преднизолон внутривенно капельно 300—500 мг/сут в течение 3 дней подряд с последующим переходом на прием внутрь 0,5 мг/кг 1 раз в сутки в течение 2—3 недель, затем быстрое снижение дозы по 5?мг каждые 3 суток до полной отмены.
Желудочно-кишечное кровотечение (в том случае, если оно обусловлено васкулитом, а не иными причинами) не является противопоказанием к назначению глюкокортикоидов внутрь, а, напротив, служит одним из основных показаний к такому лечению. Противопоказанием к назначению глюкокортикоидов внутрь при абдоминальном синдроме может быть только перфорация стенки кишки, которая в настоящее время крайне редко осложняет течение пурпуры Шенлейна—Геноха.
Наибольшие проблемы медикаментозного лечения пурпуры Шенлейна—Геноха связаны с выбором средств лечения хронического гломерулонефрита. Большинство авторов считают оправданным применение сверхвысоких доз глюкокортикоидов, цитостатиков и/или сеансов плазмафереза в случае тяжелого гломерулонефрита (нефротический синдром с нормальной или нарушенной функцией почек; более 50% клубочков с эпителиальными «полулуниями»).
В этом случае используется следующая схема:
- преднизолон внутрь 1 мг/кг 1 раз в сутки в течение 4—6 недель, затем снижение дозы по 2,5 мг/недель до полной отмены или преднизолон внутривенно капельно 15?мг/кг 1 раз в сутки в течение 3 дней подряд (всего 6—20 трехдневных «пульсов» с интервалом в 3—4 недели);
+ - циклофосфамид внутривенно капельно 15 мг/кг 1 раз в 3—4 недели, под контролем уровня лейкоцитов периферической крови и трансаминаз (всего 6—20 «пульсов»);
+ - плазмаферез с объемом эксфузии 30—60?мл/кг, 10—14 сеансов.
В единичных неконтролируемых исследованиях показана эффективность при тяжелых вариантах поражения почек комбинации глюкокортикоидов и азатиоприна, а также комбинации глюкокортикоидов и циклофосфамида с антиагрегантами или антикоагулянтами.
Кроме того, для лечения больных с нефротическим и быстропрогрессирующим гломерулонефритом предлагается использовать внутривенные иммуноглобулины:
иммуноглобулин человеческий нормальный внутривенно по 400—1000 мг/кг в течение 1—5 сут, повторные курсы 1 раз в месяц в течение 6 месяцев.
В отношении менее тяжелых форм гломерулонефрита единства мнений нет. При изолированной микрогематурии, минимальной протеинурии (до 0,5 г/сут) и сохранной функции почек, как правило, активного иммуносупрессивного лечения не требуется. При умеренной протеинурии (0,5—1 г/сут) показано назначение лекарственных средств, влияющих на неиммунные механизмы прогрессирования поражения почек: ингибиторы ангиотензинпревращающего фермента и/или антагонисты рецепторов ангиотензина II (в связи с их способностью уменьшать внутриклубочковую гипертензию и выраженность протеинурии), статины (при нарушении липидного обмена). В некоторых ретроспективных исследованиях показан благоприятный эффект тонзиллэктомии на течение нетяжелых форм гломерулонефрита при пурпуре Шенлейна—Геноха.
Коррекция нарушений гемостаза, ранее считавшаяся первоочередной задачей в лечении пурпуры Шенлейна—Геноха, в настоящее время рассматривается лишь в качестве вспомогательного метода терапии, перспективы которого оцениваются скептически. В практическом плане представляют интерес сообщения японских исследователей о благоприятном долгосрочном клиническом и патоморфологическом эффекте фибринолитической терапии урокиназой на течение гломерулонефрита при пурпуре Шенлейна—Геноха:
урокиназа внутривенно медленно 5000 МЕ/кг 3 раза в неделю в течение 3—12?недель.
По мнению авторов, действие урокиназы может быть основано на уменьшении выраженности внутриклубочковой гиперкоагуляции и растворении депозитов фибриногена/фибрина.
Прогноз
Важным клиническим прогностическим фактором, определяющим частоту развития ХПН, является выраженность протеинурии. Так, если при минимальной протеинурии ХПН развивается у 5% больных, то при нефротическом синдроме этот показатель повышается до 40—50%. Наиболее неблагоприятным в отношении развития ХПН является сочетание нефротического синдрома с артериальной гипертензией и нарушением функции почек в дебюте гломерулонефрита.
Наиболее важным морфологическим критерием для определения прогноза поражения почек считают долю почечных клубочков с «полулуниями» от общего числа клубочков. Так, по данным французских авторов, наблюдавших 151 больного от 1 года до 18 лет, при наличии «полулуний» больше, чем в 50% клубочков терминальная почечная недостаточность развилась у 37% больных, а еще у 18% гломерулонефрит имел хроническое прогрессирующее течение. С другой стороны, у 85% пациентов, достигших терминальной почечной недостаточности, «полулуния» имелись более чем в половине почечных клубочков. У 70% больных с полным выздоровлением или минимальными изменениями в анализах мочи «полулуний» в клубочках не было найдено.
Важно, что у большинства больных с поздним прогрессированием гломерулонефрита отсутствуют клинические признаки активности почечных и внепочечных поражений, что объясняют преимущественным влиянием на течение почечного поражения неиммунных механизмов прогрессирования. В связи с этим у всех больных пурпурой Шенлейна—Геноха с поражением почек крайне важным является тщательный контроль артериального давления и коррекция метаболических нарушений, в частности гиперурикемии и дислипидемии.
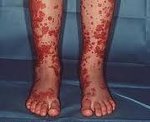
Геморрагический васкулит — системное асептическое воспаление сосудов микроциркуляторного русла с преимущественным поражением кожи, суставов, желудочно-кишечного тракта и почечных клубочков. Протекает с явлениями геморрагической или уртикарной сыпи, артралгиями, абдоминальным болевым синдромом, гематурией и почечной недостаточностью. Диагностика основана на клинических симптомах, лабораторных данных (анализ крови, мочи, коагулограмма), исследовании органов ЖКТ и почек. Основой лечения васкулита является терапия антикоагулянтами, ангиагрегантами. В тяжелых случаях применяется экстракорпоральная гемокоррекция, глюкокортикоидная терапия, противовоспалительное, цитостатическое лечение.
МКБ-10
Общие сведения
Геморрагический васкулит (ГВ, болезнь Шенлейн-Геноха, аллергическая пурпура, капилляротоксикоз) относится к наиболее распространенным на сегодняшний день геморрагическим заболеваниям. По сути своей он является аллергическим васкулитом поверхностного характера с поражением мелких артериол, венул, а также капилляров. В Международной классификации болезней (МКБ) заболевание имеет название "аллергическая пурпура". Болезнь Шенлейн-Геноха встречается в основном в детском возрасте – от 5 до 14 лет. Средняя распространенность среди детей этого возраста составляет 23-25 случая на 10 тыс. Наиболее подвержены заболеванию лица в возрасте 7-12 лет. У детей до 3 лет известны лишь отдельные случаи возникновения пурпуры.

Причины
Этиологические аспекты изучены не до конца, известно лишь, что в большинстве случаев патология носит инфекционно-аллергическую природу. Существует сезонная зависимость ‒ наибольшая заболеваемость регистрируется в сырое и холодное время года. Многолетние наблюдения позволили выявить общие триггерные факторы, предшествующие развитию клинических проявлений. К их числу относят:
- Инфекционные заболевания. У большинства заболевших манифестации васкулита предшествует острая инфекция дыхательных путей (трахеобронхит, тонзиллит, ринофарингит). Наиболее часто из смывов носоглотки удается выделить β-гемолитический стрептококк, золотистый стафилококк, кишечную палочку, аденовирус, ВПГ 1 и 2 типов. Меньшая часть больных детей инфицирована цитомегаловирусом, вирусом Эпштейна-Барр, хламидиями, микобактериями туберкулеза, вирусом гепатита В.
- Лекарственная терапия. В ревматологии имеются сообщения о развитии геморрагического васкулита на фоне использования фармакопрепаратов: антибиотиков (пенициллинов, макролидов), НПВС, антиаритмических средств (хинидин). Спровоцировать явления аллергической пурпуры может профилактическая вакцинация, проведенная сразу после перенесенной ОРВИ.
- Аллергическая отягощенность. В анамнезе пациентов с ГВ нередко имеются указания на наличие различных видов аллергии (медикаментозной, пищевой, холодовой). Больные часто страдают аллергическим дерматитом, поллинозом, аллергическим ринитом или проявлениями экссудативно-катарального диатеза.
- Другие эндогенные и внешние причины. В числе производящих факторов может выступать переохлаждение, избыточная инсоляция, укусы насекомых, травмы. У некоторых больных манифестация заболевания наступает на фоне беременности, сахарного диабета, злокачественных опухолей, цирроза печени.
Во многих наблюдениях причинный фактор, вызвавший возникновение васкулита, установить не удается. Ряд авторов высказывает предположение, что воздействие провоцирующих факторов приводит к развитию геморрагического васкулита лишь в тех случаях, когда оно осуществляется на фоне генетической предрасположенности организма к гиперергическим иммунным реакциям.
Патогенез
В основе механизма развития геморрагического васкулита лежит образование иммунных комплексов и повышение активности белков системы комплемента. Циркулируя в крови, они откладываются на внутренней поверхности стенки мелких сосудов (венул, артериол, капилляров), вызывая ее повреждение с возникновением асептического воспалительного процесса. Воспаление сосудистой стенки в свою очередь приводит к повышению ее проницаемости, отложению в просвете сосуда фибрина и тромботических масс, что обуславливает основные клинические признаки заболевания — кожно-геморрагический синдром и микротромбирование сосудистого русла с поражением ЖКТ, почек, суставов.
Классификация
В клиническом течении капилляротоксикоза различают острую фазу (начальный период или обострение) и фазу стихания (улучшение). По преобладающим симптомам заболевание классифицируют на следующие клинические формы: простую, ревматоидную (суставную), абдоминальную и молниеносную. В соответствии с характером течения различают острый (до 2-х мес.), затяжной (до полугода) и хронический ГВ. По тяжести клинических проявлений выделяют васкулит:
- Легкой степени. Отмечается удовлетворительное состояние пациентов и необильный характер сыпи, артралгии.
- Средней степени. Состояние больного средней тяжести, высыпания обильные, артралгии сопровождаются изменениями в суставах по типу артрита, отмечаются периодические боли в животе и микрогематурия.
- Тяжелой степени. Имеет место тяжелое состояние больного, сливные обильные высыпания с некротическими участками, ангионевротические отеки, нефротический синдром, наблюдается макрогематурия и желудочно-кишечные кровотечения, возможно развитие острой почечной недостаточности.
Симптомы
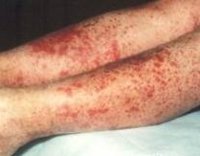
Для клиники аллергической пурпуры типично острое начало с повышением температуры до субфебрильных или фебрильных цифр. Однако возможно отсутствие подъема температуры. Кожный синдром отмечается в самом дебюте заболевания и наблюдается у всех больных. Он характеризуются диффузными пятнисто-папулезными геморрагическими элементами различной величины (чаще мелкими), не исчезающими при надавливании. В некоторых случаях наблюдается уртикарная сыпь. Высыпания обычно располагаются симметрично на коже голеней, бедер и ягодиц, в области крупных суставов, реже — на коже рук и туловища. Обильность высыпаний часто коррелирует с тяжестью васкулита. При наиболее тяжелом его течении в центре некоторых элементов сыпи развивается некроз и образуется язва. Разрешение сыпи заканчивается длительно сохраняющейся гиперпигментацией. При хроническом течении ГВ с частыми рецидивами на коже после исчезновения сыпи возникает шелушение.
Суставной синдром развивается у 70% пациентов. Поражения суставов могут носить кратковременный характер в виде легкой артралгии или сохраняться в течение нескольких дней с выраженным болевым синдромом, сопровождающимся другими симптомами артрита (покраснение, отечность) и приводящим к ограничению движений в суставе. Типичным является летучий характер поражения с вовлечением преимущественно крупных суставов, чаще коленных и голеностопных. Суставной синдром может появиться в начальном периоде васкулита или возникнуть позже. Зачастую он имеет преходящий характер и никогда не приводит к стойкой деформации суставов. Абдоминальный синдром может предшествовать кожно-суставным проявлениям или сопутствовать им. Он проявляется болями в животе различной интенсивности – от умеренных до приступообразных по типу кишечной колики. Пациенты часто не могут указать точную локализацию боли, жалуются на нарушения стула, тошноту и рвоту. Абдоминалгии могут появляться несколько раз в течение суток и проходят самопроизвольно или в первые несколько дней лечения.
Почечный синдром возникает у 25-30% пациентов и проявляется признаками хронического или острого гломерулонефрита с различной степенью гематурии. У ряда больных возникает нефротический симптомокомплекс. Поражение других органов при геморрагическом васкулите происходит довольно редко. Это может быть геморрагическая пневмония в виде кашля с прожилками крови в мокроте и одышки, кровоизлияния в эндокард, геморрагический перикардит, миокардит. Поражение сосудов головного мозга проявляется головокружением, раздражительностью, головной болью, эпиприступами и может вызвать развитие геморрагического менингита.
Осложнения
Поражение почек является самым стойким синдромом геморрагического васкулита, может осложняться злокачественным гломерулонефритом и хронической почечной недостаточностью. В тяжелых случаях аллергической пурпуры возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и присутствием крови в каловых массах, легочные кровотечения, кровоизлияния в вещество головного мозга (геморрагический инсульт). Массивные кровопотери могут привести к коллапсу и анемической коме. Осложнения абдоминального синдрома встречаются реже и представлены инвагинацией кишечника, перитонитом, тромбозом брыжеечных сосудов, некрозом части тонкого кишечника. Наибольшая частота летальных исходов регистрируется при молниеносной форме ГВ.
Диагностика
Проводя диагностику, ревматолог учитывает возраст пациента, изучает этиофакторы, сопоставляет клинические и лабораторные данные, исключает другие заболевания. При развитии почечного синдрома пациенту необходима консультация нефролога, при наличии абдоминальных болей – консультация гастроэнтеролога и хирурга. Диагностическая панель включает:
- Гематологические тесты. В общем анализе крови, как правило, отмечаются неспецифические признаки умеренного воспаления (лейкоцитоз и небольшое повышение СОЭ), увеличение количества тромбоцитов и эозинофилов. Биохимический анализ крови показывает увеличение иммуноглобулина А и СРБ. Большое диагностическое значение имеют результаты коагулограммы. Отсутствие в ней данных за нарушение свертывания при наличии клинических признаков геморрагического синдрома свидетельствует в пользу ГВ.
- Анализы мочи и кала. В анализе мочи выявляется гематурия, протеинурия, цилиндрурия. Пациентам с почечным синдромом показан мониторинг изменений в анализе мочи, проведение биохимии мочи, пробы Зимницкого, Нечипоренко. Для диагностики скрытого ЖКТ-кровотечения производят анализ кала на скрытую кровь.
- Инструментальную диагностику. С целью оценки состояния органов-мишеней выполняется УЗИ почек, УЗДГ почечных сосудов. Для исключения органических причин кровотечения из пищеварительного тракта и бронхов целесообразно проведение УЗИ брюшной полости, гастроскопии, бронхоскопии.
- Биопсию с гистологией. В тяжелых диагностических случаях показана биопсия кожи или почек. Гистологическое исследование биоптата выявляет характерные изменения: отложения иммуноглобулина А и ЦИК на эндотелии и в толще сосудистой стенки венул, артериол и капилляров; образование микротромбов; выход элементов крови за пределы сосуда.
Абдоминальную форму геморрагического васкулита следует дифференцировать от других причин, обуславливающих появление симптомов «острого живота»: аппендицита, пенетрации язвы желудка, острого холецистита, панкреатита, перфорации кишечника при язвенном колите др. Также необходимо исключить тромбоцитопеническую пурпуру, геморрагический синдром при инфекционных заболеваниях (геморрагических лихорадках, гриппе), лейкоз, ревматоидный артрит, болезнь Стилла, острый гломерулонефрит, системные васкулиты.
Лечение
В острой фазе геморрагического васкулита пациентам необходимо соблюдать постельный режим и гипоаллергенную диету, ограничить употребление жидкости и соли, исключить прием антибиотиков и других медикаментов, которые могут усиливать сенсибилизацию организма. Основные направления терапии зависят от клинических проявлений, поэтому их целесообразно рассматривать посиндромно:
- При любых синдромах. Основу базисной терапии при всех формах ГВ составляет назначение дезагрегантов (дипиридамола, пентоксифиллина) и активаторов фибринолиза (никотиновой кислоты). Препараты этих групп препятствуют агрегации тромбоцитов, улучшают микроциркуляцию и внутритканевую перфузию. Часто в базисную схему включают гепарин и другие антикоагулянты.
- При кожном синдроме. Терапия предполагает применение сульфасалазина, колхицина. Использование преднизолона до сих пор является спорным вопросом среди врачей. Возможно его назначение в тяжелых случаях ГВ. При отсутствии эффекта от терапии кортикостероидами препаратами запаса являются цитостатики.
- При суставном синдроме. Выраженные артралгии купируются проведением противовоспалительной терапии (индометацин, ибупрофен). Дополнительно могут назначаться производные аминохинолина (хлорохин).
- При почечном синдроме. Назначаются высокие дозы глюкокортикоидов, цитостатиков. Возможно использование иАПФ, антагонистов рецепторов ангиотензина II, введение нормального человеческого иммуноглобулина, проведение электрофореза с никотиновой кислотой и гепарином на область почек. В терминальной стадии ХПН требуется гемодиализ или трансплантация почки.
- При абдоминальном синдроме. Интенсивный болевой синдром служит показанием к внутривенному введению преднизолона, реополиглюкина, кристаллоидов. При развитии хирургических осложнений (перфорация, инвагинация кишки) применяется хирургическая тактика.
Тяжелое течение заболевания является показанием для проведения экстракорпоральной гемокоррекции (гемосорбция, иммуносорбция, плазмаферез). Многие авторы отмечают неэффективность антигистаминных препаратов в лечении ГВ. Однако их применение может быть оправдано у пациентов с аллергическим анамнезом. При связи заболевания с пищевой аллергией и наличием абдоминального синдрома дополнительно назначаются энтеросорбенты.
Прогноз и профилктика
Легкие формы геморрагического васкулита склонны к самопроизвольному излечению после первой же атаки заболевания – их прогноз благоприятен. При молниеносной форме смерть пациентов может произойти в первые несколько суток от начала заболевания. Чаще всего это связано с поражением сосудов ЦНС и возникновением внутримозгового кровоизлияния. Другой причиной летального исхода может стать тяжелый почечный синдром, приводящий к развитию уремии. В целях профилактики аллергического васкулита рекомендуется санация хронических инфекционных очагов ЛОР органов, дегельминтизация при глистных инвазиях, исключение контакта с известными аллергенами и бесконтрольного приема медикаментов.