Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ.
Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза:
• миоглобин — мышечный белок (норма в крови — до 40 нг/мл), при повреждении миокарда повышается уже через 1—2 ч в 10 раз и более (максимум повышения — через 4—8 ч). Нормализация происходит к концу первых суток ИМ. Специфичность этого фермента для патологии миокарда не столь высока;
• тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода).
Поэтому тропонины не только высокоспецифичные, но и «поздние» диагностические маркеры, позволяющие выявить «пропущенный» ИМ, протекавший ранее без явных клинических и ЭКГ-признаков заболевания. У больных ИМ, доставленных через 48—72 ч от начала появления симптоматики, особенно при минимальных изменениях ЭКГ, предпочтительнее использовать тропониновый тест (он остается повышенным в течение 7—14 дней);
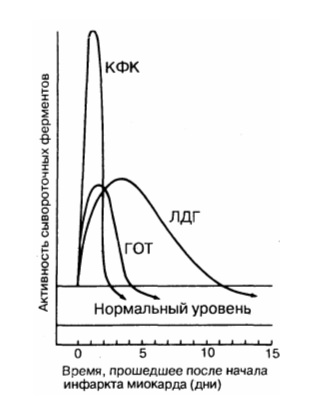 Динамика сывороточных ферментов после типичного инфаркта миокарда.
Динамика сывороточных ферментов после типичного инфаркта миокарда.
КФК – креатинфосфокиназа; ЛДГ – лактатдегидрогеназа; ГОТ – глутаматрксалоацетаттрансаминаза.
• изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК);
• суммарная КФК (норма – 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза.
Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных.
В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q.
Критерии диагностики острого инфаркта миокарда представлены соответствующими клиническими симптомами, характерными ЭКГ-изменениями и повышением кардиальных протеинов в сыворотке или плазме крови.
До недавнего времени лабораторная диагностика острого инфаркта миокарда зависела, главным образом, от определения активности СК и СК-МВ, но обнаружено, что при этих исследованиях часто не выявляют малые, нетрансмуральные инфаркты (без-Q-инфаркты). Более того, диагностическая чувствительность этих маркеров значительно ниже на ранних этапах приступа, чем у миоглобина, тогда как диагностическая специфичность их сопоставима. Кроме того, определение содержания миоглобина подтверждает нормализацию кровообращения в коронарных сосудах в первые 2 ч после начала фибринолитической терапии.
По сравнению с измерением каталитической активности СК-МВ, иммунохимическое определение СК-МВ (как СК-МВ концентрации, или СК-МВ-mass) обладает значительно большей диагностической чувствительностью, особенно на ранней стадии заболевания. В противоположность измерению иммунного ингибирования названных маркеров определение концентрации не дает ложноположительных высоких значений, если в сыворотке присутствуют другие изоэнзимы (СК-ВВ) или изоформы (т.е. макро-СК). Анализ СК-МВ-активности – очень нечувствительный метод, в диапазоне приближения к 10 Е/л. По сравнению с анализом концентрации, детекция измеряемого нарастания СК-МВ задерживается. Замечено, однако, что СК-МВ образуется не только в миокарде, но и в скелетных мышцах. По этой причине данный маркер нельзя считать параметром, специфичным для миокарда.
Измеряемыми высокоспецифичными для миокарда параметрами можно определить компоненты тропонинового комплекса. Изоформы
Тропонина I, так же, как и тропонина Т, значительно отличаются по аминокислотной последовательности в сердечной и скелетных мышцах. Это дает возможность получить специфичные антитела против кардиальных изоформ тропонинов Т и I и использовать их в тест-системах.
Таблица 13-1. Сравнение результатов измерений cTnl и cTnT у больных с острым инфарктом миокарда (по данным J Mair e.a. 1996, Clinica Chimica Acta v.245 pp.19-38)
 Примечания. TnI – тропонин I; TnT – тропонин T; cTnI – концентрация тропонина I; cTnT – концентрация тропонина T.
Примечания. TnI – тропонин I; TnT – тропонин T; cTnI – концентрация тропонина I; cTnT – концентрация тропонина T.
Тропонин I и Тропонин Т – компоненты сократительного аппарата, т.е. структурно связанные белки кардиомиоцитов. Тогда как растворенные в цитозоле белки (миоглобин) относительно быстро вымываются из зоны некроза, деструкция сократительного аппарата более продолжительна во времени, так что увеличение содержания тропонина определяют до 8-10 дней после острого приступа.
Определение содержания сердечных тропонинов I и Т дает возможность диагностики микронекроза миокарда, иногда возникающего в случае нестабильной стенокардии. Такие повышения концентрации тропонина имеют высокое прогностическое значение (по отношению к инфарктам и смерти), что дает возможность оценивать степень риска пациентов со стенокардией. Диагностическая оценка этих методов включает серийные исследования у пациентов с острым инфарктом миокарда и пациентов со стенокардией в сравнении с определением миоглобина, КК-МВ-mass и других лабораторных тестов.
Таблица 13-2. Диагностическая чувствительность и специфичность лабораторных тестов при инфаркте миокарда
 Таблица 13-3. Временные интервалы диагностической значимости исследования изменений маркеров ОИМ
Таблица 13-3. Временные интервалы диагностической значимости исследования изменений маркеров ОИМ
 Таблицы показывают диагностическую чувствительность лабораторных методов при остром инфаркте миокарда в зависимости от длительности симптомов. Обнаружено, что диагностическая чувствительность всех параметров при ИМ зависит от длительности болевого приступа. Если боль отмечена в течение 4-6 ч, концентрация миоглобина повышается у всех пациентов с острым инфарктом миокарда, тогда как СК-МВ/mass увеличивется у 83%, а содержание тропонина – у 50% больных. Общая чувствительность для трех параметров становится 98%. Содержание миоглобина начинает увеличиваться раньше остальных и потом возвращается к отсекающему значению на 2-й день, тогда как СК-МВ/mass нормализуется между 3-м и 4-м днем, а тропонин I – между 6-м и 8-м днем. Содержание тропонина I достигает максимума на 2-й день. Это максимальное значение в 30-50 раз превышает отсекающее. Величина отличия от отсекающего значения для тропонина I больше, чем для миоглобина (в 8-10 раз) или СК-МВ/mass (в 14-36 раз). У пациентов, которых лечили с применением чрескожной баллонной ангиопластики, выявляют более выраженное увеличение всех маркеров, чем у тех, кто получал тромболитическую терапию и консервативное лечение. У больных со стабильной стенокардией может повышаться концентрация миоглобина и СК-МВ/mass и отсутствовать изменение содержания сердечных тропонинов, что служит дифференциально-диагностическим критерием.
Таблицы показывают диагностическую чувствительность лабораторных методов при остром инфаркте миокарда в зависимости от длительности симптомов. Обнаружено, что диагностическая чувствительность всех параметров при ИМ зависит от длительности болевого приступа. Если боль отмечена в течение 4-6 ч, концентрация миоглобина повышается у всех пациентов с острым инфарктом миокарда, тогда как СК-МВ/mass увеличивется у 83%, а содержание тропонина – у 50% больных. Общая чувствительность для трех параметров становится 98%. Содержание миоглобина начинает увеличиваться раньше остальных и потом возвращается к отсекающему значению на 2-й день, тогда как СК-МВ/mass нормализуется между 3-м и 4-м днем, а тропонин I – между 6-м и 8-м днем. Содержание тропонина I достигает максимума на 2-й день. Это максимальное значение в 30-50 раз превышает отсекающее. Величина отличия от отсекающего значения для тропонина I больше, чем для миоглобина (в 8-10 раз) или СК-МВ/mass (в 14-36 раз). У пациентов, которых лечили с применением чрескожной баллонной ангиопластики, выявляют более выраженное увеличение всех маркеров, чем у тех, кто получал тромболитическую терапию и консервативное лечение. У больных со стабильной стенокардией может повышаться концентрация миоглобина и СК-МВ/mass и отсутствовать изменение содержания сердечных тропонинов, что служит дифференциально-диагностическим критерием.
У пациентов с нестабильной стенокардией возможно повышение концентрации тропонина I и СК-МВ/mass, тогда как содержание миоглобина
не изменяется. Миоглобин, СК-МВ/mass и тропонин I показывают высокую чувствительность (98%) в распознавании острого инфаркта миокарда, в то же время кинетика их изменений различна. Значения содержания миоглобина нормализуются на 2-й день после приступа, СК-МВ/mass – между 3-м и 4-м днем, а тропонина I – между 6-м и 8-м днем. Если набор симптомов неизвестен, то динамика этих трех параметров и согласование ее по каждому в отдельности дает возможность дать заключение о характере клинической картины.
Еще недавно многие медицинские центры в практике использовали оценку динамики ферментов СК и СК-МВ с интервалами 4-8 ч. Сейчас доступность иммунохимического определения содержания миоглобина, СК-МВ/mass и тропонина I имеет несколько преимуществ. Время, необходимое для анализа, коротко, созданы условия для определения единичного образца. Более того, исследования обеспечивают новые возможности в диагностической чувствительности и специфичности, контроле лечения, оценке риска в развитии заболевания, последующих особенностей нестабильной стенокардии. Имея в виду различия в кинетике этих маркеров инфаркта миокарда, необходимо четкое согласование времени забора крови у пациента. Стандартный подход:
• забор крови при поступлении в медицинский центр;
• через 2 ч после начала болевого симптома;
• затем ежедневно в течение 8 дней для контроля лечения и определения прогноза заболевания.
Одна из наиболее важных функций врача-лаборанта – интерпретация патологических лабораторных результатов исследований. Часто клиницисты, назначающие серию лабораторных исследований своим пациентам, сталкиваются с огромным, приводящим в замешательство набором цифр, которые трудно оценить. Врач-лаборант должен не только объяснить патологические результаты, но и подсказать, какие еще исследования необходимо провести пациенту, чтобы подтвердить или опровергнуть диагноз (Tanker, 1987; Statlan, 1988). Врач-лаборант должен сам выявить патологические результаты и приложить силы и знания к их объяснению даже без запроса о консультации. Если необходимо объяснить некоторые патологические результаты, какие-то исследования активно повторяют или заказывают дополнительные, чтобы оценить состояние пациента. Обычно необходимо обращать внимание на результаты, которые не вписываются в общую картину, не коррелируют друг с другом. В большинстве случаев эти результаты совпадают, будучи истинно положительными (болезнь есть, и тест ее подтверждает) или истинно
отрицательными (болезни нет, и тест ее исключает). Однако результаты могут быть и ложноотрицательными (болезнь есть, но тест ее исключает), и ложноположительными (болезни нет, но тест ее подтверждает). Вероятность положительного результата диагностического теста в присутствии болезни называют чувствительностью метода, а вероятность отрицательного результата в отсутствии болезни – его специфичностью.
Проанализируем, как можно использовать эти критерии у больных с инфарктом миокарда. Диагностическая чувствительность теста определяет вероятность положительного результата и показывает, с какой степенью уверенности можно ожидать положительного результата теста у больных:
• диагностическая чувствительность (ДЧ) = количество больных с ИМ, имеющих положительный результат теста / количество всех больных с ИМ;
• диагностическая специфичность (ДС) = количество пациентов без инфаркта миокарда, имеющих отрицательный результат / количество всех протестированных пациентов без инфаркта миокарда.
Для клинициста важнейшее значение имеет вопрос: как велика вероятность того, что ИМ есть на самом деле, если результат теста положительный, или с какой надежностью можно исключить поражение миокарда, если тест отрицательный. На эти вопросы можно ответить, используя предсказательную ценность положительного теста (ПЦП) и предсказательную ценность отрицательного теста (ПЦО).
• ПЦП = количество больных с ИМ с положительным результатом теста / количество больных с ИМ с положительным результатом теста + больные без инфаркта миокарда с ложноположительным результатом теста.
• ПЦО = количество больных без инфаркта миокарда с отрицательным результатом теста / количество всех отрицательных результатов (т.е. отрицательные + ложноотрицательные).
Таблица 13-4. Диагностические критерии у больных ИМ для различных тестов
 В настоящее время многие больницы в США активно разрабатывают нормированные пути (НП) для пациентов с различными заболеваниями. Основная цель создания НП – уменьшение длительности пребывания пациента в больнице и издержек, сопутствующих лечебно-диагностическому процессу. Обычно НП в клинической практике применяют для большого объема, высокого риска и высокой стоимости нозологий и процедур. В НП прослеживаются следующие аспекты процесса лечения пациента: консультации и оценки, тесты, лечение, пища, медикаменты (способ введения внутривенный и другой), активность (действие) или безопасность, планирование разгрузки и координация, другие дополнительные категории, основанные на определенном диагнозе или процедуре.
В настоящее время многие больницы в США активно разрабатывают нормированные пути (НП) для пациентов с различными заболеваниями. Основная цель создания НП – уменьшение длительности пребывания пациента в больнице и издержек, сопутствующих лечебно-диагностическому процессу. Обычно НП в клинической практике применяют для большого объема, высокого риска и высокой стоимости нозологий и процедур. В НП прослеживаются следующие аспекты процесса лечения пациента: консультации и оценки, тесты, лечение, пища, медикаменты (способ введения внутривенный и другой), активность (действие) или безопасность, планирование разгрузки и координация, другие дополнительные категории, основанные на определенном диагнозе или процедуре.
В нашем представлении НП – оптимальная последовательность действий по времени и выбор времени вмешательств всех участников технологического процесса производства результатов исследований с целью снижения задержки и расхода ресурсов и максимального повышения качества результатов лабораторных исследований. Другими словами, НП – способ визуализации всех частей единого технологического процесса производства анализов (от назначения исследований клиницистом, подготовки пациента до получения результатов и использования их в диагностике и лечении). Таким образом, если предложенная индустриальная модель технологического процесса производства результатов лабораторных исследований определяет, что и как необходимо делать, то НП показывают, когда необходимо вмешаться в технологический процесс, и на каком этапе, чтобы снизить количество ошибок, расход ресурсов (моноветы, реактивы, калибраторы и т.д.) и чтобы результаты исследований максимально соответствовали реальным. Мы приводим нормированный путь проведения биохимических исследований для пациента с подозрением на инфаркт миокарда (ИМ). Следует подчеркнуть, что НП для экстренных исследований значительно отличается от НП для плановых исследований. Общее требование для экстренных исследований – выполнение их в течение 45-60 мин после доставки материала в лабораторию, а на исследование жизненно важных параметров (например, содержание гемоглобина, гематокрит, КЩС, концентрация калия и глюкозы) отводят 3-5 мин.
Схема показывает, как «работает» НП диагностики ИМ. После назначения исследований АСТ, АЛТ, КК, КК-МВ, тропонина Т задействуют критерии (пороги) этого этапа.
• Первый порог. Когда можно назначать эти исследования? – Такие исследования для экстренной диагностики могут быть выполнены в любое время, поэтому их не включают в последующий анализ;
• Второй порог. Сколько времени прошло после острого ангинозного приступа? – В нашем примере прошло 6 ч, значит, пороги не задействуют, а если бы после острого приступа прошло 5 сут, порог бы включился, так как в этот период ИМ определение миоглобина для диагностики заболевания не используются.
На этапе технологической операции взятия крови на исследования, несмотря на неподготовленность пациента к исследованиям, порог не включается, так как неотложные исследования проводят без подготовки, а если бы пациенту были назначены плановые биохимические исследования, то этот порог включился бы и потребовал вмешательства специалистов лаборатории для устранения отклонений от НП. Кровь на исследования у пациента с подозрением на ИМ необходимо взять в течение 10 мин после получения процедурной сестрой заявки и в течение такого же времени доставить в лабораторию. Отклонения по времени на этих этапах также анализируют и по ним вырабатывают программы устранения причин, приводящих к нарушениям. Аналогичным образом работают критерии порогов для технологических операций взятия, приема и обработки крови.
В случае получения результатов исследований, требующих немедленных действий со стороны клинициста, врач-лаборант срочно информирует его об этом. По этой причине в нашем случае при получении повышенных значений КК, КК-МВ, миоглобина врач-лаборант сообщает клиницисту о результатах (критерий не включается) и только затем приступает к написанию заключения.
На этапе технологической операции передачи результатов исследований врач-лаборант обязан указать время поступления материала в лабораторию и время выдачи ответа, а также убедиться в том, что клиницист получил результаты. Выполнение этих порогов имеет большое значение, особенно при проведении экстренных исследований и исследований по жизненным показаниям, так как устраняет повод для разбирательства в случаях, если лаборатория сталкивается с низкой ответственностью клинициста, который в качестве своего оправдания бездействия ссылается на то, что он не был вовремя информирован о результатах исследований.
На этапе передачи результатов исследований НП не заканчивается, так как он должен обязательно включать постаналитическую часть единого технологического процесса производства анализов. Эта часть техно – логического процесса не менее важна, чем предыдущие, так как она позволяет оценить все предыдущие этапы. Администратором на этом этапе НП становится клиницист, он отвечает за интерпретацию и использование полученной лабораторной информации. Критерии НП на постаналитической части:
• соответствуют ли результаты исследований объективному состоянию пациента;
• отражены ли результаты исследований в истории болезни;
• какие действия предприняты клиницистом по результатам исследований;
• повлияли ли результаты исследований на качество оказания медицинской помощи пациенту.
Если результаты исследований не востребованы клиницистом, это становится критерием срабатывания порогов и служит материалом для анализа и выяснения причины, почему это происходит. Врач-лаборант не должен устраняться от анализа причин срабатывания порогов на постаналитической части технологического процесса, так как в противном случае это приведет к нарушению взаимодействия всех участников НП. Кроме того, НП становится законченным только в этом частном случае, а при проведении лечения пациента он повторится через какое-то время (исследования будут назначены повторно для оценки проводимого лечения, определения прогноза или диагностики возникших осложнений), и оценивать его придется уже в динамике, с учетом выявленных отклонений в предыдущем случае.
На фоне успешного развития электрокардиографии лабораторные методы долго играли весьма скромную роль в диагностике инфаркта миокарда. Давно известное врачам повышение в крови больных с инфарктом количества лейкоцитов и увеличение СОЭ слишком неспецифичны, чтобы на них строить диагностическое заключение. Интерес к возможности лабораторной диагностики некроза сердечной мышцы увеличился после того, как в 50-х годах было установлено, что крови больных с острым инфарктом миокарда закономерно повышается уровень аспартатаминотрансферазы (ACT) — фермента, содержащегося в кардиомиоцитах и попадающего в кровоток после их гибели. Однако ACT, к сожалению, также оказалась малоспецифичным маркером некроза именно миокарда. Этот фермент содержится почти во всех тканях организма и, соответственно, повышается при самых разных заболеваниях, в том числе и тех, которые требуют дифференциальной диагностики с инфарктом миокарда, – тромбоэмболии легочной артерии, расслаивающей аневризме аорты, заболеваниях поджелудочной железы, печени и т.д. Единственным, пожалуй, исключением были ситуации, когда надо было дифференцировать инфаркт миокарда с затяжным приступом стенокардии. Но здесь возникали проблемы в связи с тем, что ACT начинает повышаться в крови только через 8-2 часов после развития некроза. В настоящее время ACT уже редко используется для диагностики инфаркта миокарда. Стандартным методом стало определение в крови больных с подозрением на некроз сердечной мышцы гораздо более специфичной креатинфосфокиназы, а если пациент был доставлен в стационар лишь через несколько дней после болевого приступа — лактатдегидрогеназы. Еще более специфичным для инфаркта миокарда является повышение активности особых разновидностей этих энзимов, обозначаемых как МВ-КФК и ЛДГ1. Для ранней диагностики инфаркта миокарда с известными оговорками используется и определение концентрации миоглобина в крови. Обсудим клиническое значение каждого из этик маркеров гибели кардиомиоцитов подробнее.
Креатинфосфокиназа (КФК) — фермент, содержащийся, главным образом, в миокарде, скелетных мышцах, головном мозге и щитовидной железе. При развитии инфаркта миокарда повышение активности КФК в крови отмечается обычно через 6 – 8 часов после начала болевого приступа и достигает максимума в среднем к концу первых суток заболевания. На 2-3-й день инфаркта активность КФК часто возвращается к норме, хотя при обширных инфарктах может держаться и дольше. Описаны редкие случаи, главным образом у пожилых больных, когда активность КФК остается повышенной в течение нескольких недель.
Столь необычный феномен связывают с формированием иммунных комплексов КФК с иммуноглобулином G, в которых фермент сохраняет свою активность.
Повышение активности КФК в крови определяется практически у всех больных с острым инфарктом миокарда. Случаи, когда она оставалась нормальной при доказанном впоследствии некрозе сердечной мышцы, в большинстве своем обусловлены несвоевременным взятием крови на анализ. Следует учитывать, что в большинстве случаев КФК существенно повышается, как говорилось выше, только через 6-8 часов после ангинозного приступа. Частота ложно-отрицательных ответов при однократном обследовании в первые 8 часов заболевания может достигать 30%. Необходимо определять активность КФК при поступлении больного в стационар и затем еще по крайней мере 2 – 3 раза с интервалом в 8 – 12 часов. В последующем анализ повторяют в случаях повторения болей сразу и через 12 и 24 часа после каждого затяжного ангинозного приступа, чтобы не пропустить рецидива инфаркта.
Отсутствие значимой концентрации КФК в других внутренних органах, кроме сердца, резко повышает специфичность этого анализа по сравнению с определением активности ACT.
Тем не менее, количество ложно-положительных результатов, по данным литературы, может достигать 15%. Это связано с тем, что, помимо острого инфаркта миокарда, существенное повышение активности КФК в крови отмечается при травмах и заболеваниях скелетных мышц, включая судороги и длительную иммобилизацию, инсультах, гипотиреозе, некоронарогенных заболеваниях миокарда. Описано также повышение КФК в крови при алкогольной интоксикации, сахарном диабете, хирургических операциях и в некоторых случаях при тромбоэмболии легочной артерии. Чрезвычайно важно, что после самых обычных внутримышечных инъекций, без которых до больниц добирается редкий больной с инфарктом миокарда, активность КФК в крови может увеличиться в 2 – 3 раза.
В большинстве случаев ошибки можно избежать, если учитывать два обстоятельства. Во-первых, при всех вышеперечисленных состояниях содержание КФК в крови обычно повышается не более чем в 2 – 3 раза, в то время как при остром инфаркте миокарда в большинстве случаев отмечается увеличение в 10 – 20 раз и больше по сравнению с нормальным уровнем. Если столь высокая концентрация КФК будет обусловлена, например, поражением скелетных мышц, то последнее будет настолько массивным, что распознать его клинически не составит труда. Во-вторых, никогда нельзя ставить диагноз только по результатам лабораторного исследования, пусть даже и такого чувствительного, как определение активности КФК. Об инфаркте миокарда можно уверенно говорить только в тех случаях, когда повышение уровня КФК сочетается с теми или иными клиническими и (или) электрокардиографическими признаками, также указывающими на некроз сердечной мышцы.
В сомнительных случаях, когда, к примеру, активность КФК повышена незначительно, при стертой клинической картине заболевания и неизвестно когда возникшей блокаде ножки пучка Гиса на ЭКГ, целесообразно прибегнуть к определению в крови изофермента КФК — MB-КФК. В отличие от других разновидностей КФК (ВВ-фракции, содержащейся, главным образом, а мозге, и ММ-фракции, выделяемой из скелетных мышц), МВ-КФК в значительной концентрации присутствует практически только в миокарде. В клинической практике считается поэтому, что повышение в крови активности МВ-КФК указывает на поражение именно сердечной мышцы.
Тем не менее специфичность даже этого анализа не является абсолютной. Описано повышение MB-КФК после очень тяжелых физических нагрузок у профессиональных спортсменов, а также после хирургических операций на тонком кишечнике, матке, предстательной железе, диафрагме, в которых этот изофермент содержится в незначительных количествах. На специфичность анализа влияет и методика определения — наиболее чувствительным является радиоиммунный метод, в то время как широко используемый метод электрофореза чаще дает ложно-положительные результаты. Естественно, что активность МВ-КФК будет повышаться не только при инфаркте, но и при некоронарогенных повреждениях сердечной мышцы — миокардитах, операциях на сердце, электроимпульсной терапии. Таким образом, хотя повышенная активность МВ-КФК и является достаточно специфичным лабораторным признаком острого инфаркта миокарда, диагностическое заключение все равно должно строиться с обязательным учетом клинической и электрокардиографической картины заболевания и никогда не может быть основано только на результатах биохимического исследования. Главным достоинством этого анализа является не то, что он позволяет поставить диагноз острого инфаркта миокарда, не выходя из лаборатории, а то, что все остальные причины повышения активности МВ-КФК в крови можно достаточно просто исключить с помощью анамнеза и простейшего клинического обследования.
Определение активности МВ-КФК в крови следует проводить в те же сроки, что и для обшей КФК, и прежде всего в тех случаях, когда у больного с подозрением на острый инфаркт миокарда имеются признаки поражения скелетных мышц или головного мозга, которые сами по себе могут вызвать появление КФК в крови, либо когда активность последней повышена незначительно или даже остается нормальной, несмотря на клинические и (или) ЭКГ-признаки инфаркта миокарда. Последнее обстоятельство особенно важно, так как имеются данные, что у больных с острым инфарктом миокарда повышенная активность МВ-КФК может определяться даже при нормальной общей активности КФК,
В большинстве клиник мира определение КФК и МВ-КФК стало стандартным обследованием даже для тех пациентов, у которых диагноз инфаркта миокарда не вызывает сомнения по данным клиники и ЭКГ. Это объясняется тем, что степень повышения их активности в крови коррелирует с размерами инфаркта миокарда и позволяет оценить опасность тяжелых нарушений гемодинамики и прогноз в целом, что очень важно для правильной тактики ведения больного. Следует только иметь в виду, что размеры инфаркта коррелируют не с максимальным значением активности КФК и МВ-КФК в крови, а с их общим количеством, попавшим в кровоток. Рассчитать этот показатель можно по специальным формулам, исходя из результатов серии анализов. Более того, если больному проводилась тромболитическая терапия, то динамика изменения активности КФК в крови может быть использована как один из лучших показателей успешности или неэффективности предпринятой попытки восстановить проходимость коронарной артерии. Реперфузия приводит к вымыванию клеточного детрита из зоны инфаркта, что обуславливает резкий и значительный подъем активности КФК в крови в первые часы после процедуры с последующим быстрым снижением до нормального уровня.
Лактатдегидрогеназа (ЛДГ). Содержание КФК и МВ-КФК в крови возвращается к норме часто уже на 2 – 3 день острого инфаркта миокарда. Поэтому, если пациент поступал в клинику позже этого срока, то для уточнения диагноза прибегают обычно к определению активности другого фермента — лактатдегидрогеназы. Активность ЛДГ в крови повышается значительно позже, чем КФК, — только через 24 – 48 часов после развития некроза, достигает максимальных значений обычно на 3 – 6 день заболевания и возвращается к норме через 1 – 2 недели. Однако определение общей активности ЛДГ оказалось хотя и чувствительным, но малоспецифичным признаком гибели кардиомиоцитов. Она повышается в крови при гемолизе, мегалобластической анемии, лейкозах, злокачественных новообразованиях, заболеваниях печени и почек, недостаточности кровообращения (в связи с застойной гепатомегалией), тромбоэмболии легочной артерии, поражениях скелетных мышц. Чрезвычайно ценным, также как в случае с КФК, оказалось то обстоятельство, что специфичность анализа можно значительно повысить, если раздельно определять активность различных изоферментов ЛДГ. Таких изоферментов известно пять.
Сердце содержит главным образом ЛДГ1, в то время как другие внутренние органы и скелетные мышцы — остальные четыре фракции (ЛДГ2 -ЛДГ5) Определение ЛДГ 1 и особенно отношения активности ЛДГ1 и ЛДГ2 (повышение этого отношения до величины: более 1 является важным диагностическим признаком) повышает специфичность и чувствительность исследования для распознавания инфаркта миокарда более чем до 90%. Тем не менее, следует учитывать, что ЛДГ1, как и MB-КФК, будет повышаться при любых поражениях миокарда, в том числе и некоронарогенных. Кроме того, активность этого изофермента в плазме повышается при гемолизе, которого необходимо избежать при взятии крови на анализ, Особенностью ЛДП является также то, что ее активность повышается в крови раньше, чем общая активность ЛДГ — иногда уже через 8 – 24 часа после приступа.
Таким образом, пациентам, поступившим в клинику с подозрением на инфаркт миокарда давностью более суток, при нормальном уровне КФК и МВ-КФК в крови для уточнения диагноза показано определение активности ЛДГ, а еще лучше ее изоферментов.
В последние годы для диагностики острого инфаркта миокарда довольно широко использовалось определение в крови концентрации миоглобина, Миоглобин — это белок, осуществляющий внутриклеточный транспорт кислорода. Он содержится и в миокарде, и в скелетной мускулатуре, т.е. его специфичность для диагностики острого инфаркта примерно такая же, как КФК, но ниже, чем МВ-КФК. Также, как КФК, уровень миоглобина может повышаться в 2 – 3 раза после внутримышечных инъекций, и диагностически значимым обычно считают повышение в 10 и более раз. Подъем уровня миоглобина в крови начинается даже раньше, чем повышение активности КФК Диагностически значимый уровень зачастую достигается уже через 4 часа и в подавляющем большинстве случаев наблюдается через 6 часов после болевого приступа. Однако держится высокая концентрация миоглобина в крови очень недолго — всего несколько часов. Маленькая молекулярная масса, гораздо меньшая, чем у КФК и других ферментов, позволяет миоглобину легко проходить через клубочковую мембрану, что приводит к быстрому падению его концентрации в плазме. Поэтому нормальные результаты определения уровня миоглобина в крови отнюдь не исключают острого инфаркта миокарда. Достаточно просто, особенно если не повторять анализ каждые 2 – 3 часа, пропустить пик его концентрации. В этом диагностическая ценность определения миоглобина значительно уступает измерению активности КФК. Не удалось, в отличие от КФК выявить и взаимосвязь между степенью повышения концентрации миоглобина и размерами инфаркта миокарда. Таким образом, определение уровня миоглобина в крови по своей диагностической значимости уступает анализам, выявляющим активность КФК, а тем более МВ-КФК. Единственно, когда можно отдать предпочтение измерению концентрации миоглобина, это случаи поступления больных в стационар менее чем через 6 – 8 часов после начала болевого приступа. Но и этот вопрос нуждается в дальнейшем изучении. Зато уже сейчас, вероятно, можно сделать заключение о нецелесообразности измерения концентрации миоглобина в моче, так как показано, что при высокой концентрационной способности почек его концентрация в моче может быть высокой и у абсолютно здоровых людей.
Если увлечение миоглобином проходит, то определение содержания в крови тропонина-Т и тропонина-1 (изоформ сократительного белка тропонииа) все более широко используется как в научных, так и в клинических целях. Эти изоформы высокоспецифичны именно для миокарда. Их чувствительность настолько велика, что даже затрудняет клиническую интерпретацию результатов анализа. Показано, что миокардиальные изоформы тропонина повышаются не только при инфаркте миокарда, но и при нестабильной стенокардии. В то же время отсутствие повышения в серии заборов крови тропонина-Т или I достаточно надежно исключает кардиальную патологию.
Как говорилось в начале данного раздела, определения активности ACT, числа лейкоцитов и скорости оседания эритроцитов в настоящее время практически уже не должны использоваться для диагностики острого инфаркта миокарда в силу крайне низкой специфичности этих показателей. Однако контроль числа лейкоцитов и СОЭ чрезвычайно важен для своевременного распознавания инфекционных или аутоиммунных осложнений в течение инфаркта миокарда.
Лейкоцитоз при остром неосложненном инфаркте миокарда появляется уже через 2-3 часа после начала ангинозного приступа, нарастает в течение 2-4 дней, а к 5 – 7 дню количество лейкоцитов обычно нормализуется. Характерным считается небольшой сдвиг лейкоцитарной формулы влево и отсутствие в крови эозинофилов. Признаками, указывающими на то, что течение самого инфаркта миокарда, вероятно, осложнилось каким-либо воспалительным процессом, можно считать количество лейкоцитов в крови более 20 – 25 тыс /мм3 с резким сдвигом формулы влево и (или) сохранение повышенного количества белых кровяных клеток более 1 недели после ангинозного приступа.
Повышение СОЭ отражает происходящее при любой некротически-воспалительной реакции изменение белкового спектра крови, в частности альфа-2 глобулина и фибриногена,. СОЭ начинает повышаться значительно позднее повышения количества лейкоцитов (обычно только на 4 – 5-й день), что приводит к известному симптому "ножниц" — СОЭ еще только нарастает, а лейкоцитоз уже снижается. При неосложненном течении инфаркта миокарда величина СОЭ редко превышает 30 – 35 мм/ч и может держаться достаточно долго — 2 – 3 недели. Очень высокое и длительно сохраняющееся СОЭ, наряду с эозинофилией, характерно для осложняющего течение инфаркта миокарда синдрома Дресслера.
Обобщая данные различных авторов, изучавших вопросы лабораторной диагностики острого инфаркта миокарда, можно предложить следующие практические рекомендации относительно использования рассмотренных методов.
· У пациентов, поступивших в течение первых 24 часов после ангинозного приступа, производится определение активности КФК в крови. Это следует делать даже в тех случаях, когда по клиническим и электрокардиографическим данным диагноз инфаркта миокарда не вызывает сомнения, так как степень повышения активности КФК информирует врача о размерах инфаркта миокарда и прогнозе.
· Если активность КФК находится в пределах нормы или повышена незначительно (в 2 – 3 раза), либо у пациента имеются явные признаки поражения скелетной мускулатуры или головного мозга, то для уточнения диагноза показано определение активности МВ-КФК.
· Нормальные величины активности КФК и МВ-КФК, полученные при однократном заборе крови в момент поступления больного в клинику, недостаточны для исключения диагноза острого инфаркта миокарда. Анализ необходимо повторить хотя бы еще 2 раза через 12 и 24 часа.
· Если больной поступил более чем через 24 часа после ангинозного приступа, но меньше чем через 2 недели, и уровень КФК и МВ-КФК нормальный, то целесообразно определить активность ЛДГ в крови, а еще лучше — измерить отношение активности ЛДГ 1 и ЛДГ2,
· Если ангинозные боли повторяются у больного после госпитализации, то рекомендуется измерять КФК и МВ-КФК сразу после приступа и через 12 и 24 часа.
· Миоглобин в крови целесообразно определять только в первые часы после болевого приступа. Повышение его уровня в 10 раз и больше указывает на некроз мышечных клеток, однако нормальный уровень миоглобина отнюдь не исключает инфаркта.
· Определение ферментов нецелесообразно у бессимптомных больных с нормальной ЭКГ. Диагноз на основании одной только гиперферментемии ставить все равно нельзя — должны быть клинические и (или) электрокардиографические признаки, указывающие на возможность инфаркта миокарда.
· Контроль количества лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные осложнения острого инфаркта миокарда.