В его основе лежит частичная или полная непроходимость магистральных вен – подколенной или бедренной. Этиология и патогенез
Врожденные странгуляции вен фиброзными тяжами, аберрантными артериальными ветвями, лимфэктазиями, сдавление вен атипично расположенными мышцами.
Врожденное отсутствие (аплазия) или гипоплазия глубоких вен.
В результате нарушения проходимости глубоких вен возникает венозная гипертензия. Кровь из глубоких вен по расширенным коммуникантам попадает в подкожные вены. Возникает тяжелая гипоксия, трофические изменения конечности, отек, лимфостаз. Все это усугубляется раскрытием артерио-венозных анастомозов, что ухудшает кровообращение.
Клиника и диагностика
При рождении у ребенка обнаруживаются пигментно-сосудистые пятна на коже конечности. Ко 2-3 годам жизни появляется варикозное расширение вен, чаще на наружной поверхности конечности. К 7 годам появляются гипертрофия мягких тканей, лимфостаз, удлинение конечности. Расширяются вены системы большой и малой подкожных вен.
Диагностика, артерио- и флебография. Дифференциальный диагноз с синдромом Паркс-Вебера-Рубашова.
Устранение странгуляций, обусловленных фиброзными тяжами, мышцами.
При аплазиях и гипоплазиях магистральных вен хирургическое лечение крайне сложно или невозможно.
Хроническая венозная болезнь Классификация
(6-ой конгресс Американского венозного форума, 1994 г. Майами)
Хроническая венозная болезнь может быть классифицирована в соответствии с клиническими признаками (С), этиологией (Е), анатомическим расположением (А) и патофизиологическими явлениями (Р).
С – клинические признаки (степень 0-6).
Е – этиологическая классификация (врожденные, первичные, вторичные).
А – анатомическое расположение (поверхностное, глубокое или перфоранты, в отдельности или в комбинации).
Р – патофизиологическая дисфункция (рефлюкс или обструкция, в отдельности или в сочетании).
С. Клиническая классификация хронической венозной болезни нижних конечностей
Стадия 0 – нет видимых или осязаемых признаков венозной болезни.
Стадия 1 – телеангиоэктазии, сетчатые венозные стволы,изменения цвета кожи (яркая гиперемия).
Стадия 2 – варикозные вены.
Стадия 3 – отек без изменений кожи.
Стадия 4 – кожные изменения, характерные для венозной болезни [пигментация, венозная экзема, липодерматосклероз (целлюлит)].
Стадия 5 – установленные выше кожные изменения с зажившей язвой
Стадия 6 – кожные изменения с активной язвой.
Е. Этиологическая классификация
Венозная дисфункция может быть врожденной, первичной или вторичной. Врожденные венозные нарушения присутствуют уже после рождения, но могут не проявляться до какого-то времени. Первичная венозная дисфункция неизвестной этиологии но не врожденного происхождения. Вторичная венозная дисфункция обозначается как приобретенная в результате тромбоза глубоких вен.
Congenital (Еc) – этиологический фактор хронической венозной болезни имеется с рождения,
Primary (Ер) – хроническая венозная болезнь имеет неопределенную этиологию,
Secondary (Еs) – хроническая венозная болезнь с определенным знанием этиологии (посттромботическая, посттравматическая, другие).
Синдром Клиппеля-Треноне – редкое врожденное заболевание, передающееся по наследству. Оно представляет собой гипертрофическую гемангиоэктазию, то есть увеличение и расширение сосудов. Чаще диагностируется у лиц мужского пола, но встречается и у женщин. Симптомы поражения выявляются в течение первых лет жизни, при этом признаки недуга у новорожденных встречаются редко. Пациенты страдают от варикоза вен нижних конечностей, формирования подкожных кровоизлияний. Поврежденная нога, как правило, увеличена, причем не только в объеме, но и в длину.
Лечение синдрома Клиппеля-Треноне хирургическое. Консервативная терапия используется в качестве поддерживающего метода. Специфических способов профилактики не разработано.
История заболевания
Впервые патология была описана еще в 1900 году. Характеристику составили два врача – Клиппель и Треноне. Позже, уже в конце XX века, она была дополнена Вебером. Поэтому в разных источниках заболеванию присваиваются различные названия. Однако использование термина «синдром Клипера» ошибочно. Медики описали патологию как проблему, сопровождающуюся формированием многочисленных дефектов вен конечностей. На сегодняшний день известно, что патологии сосудистого русла могут образовываться и во внутренних органах.

Причины появления синдрома Клиппеля-Треноне
Заболевание имеет генетическую природу, то есть ему свойственно наследование. Передается нарушение по аутосомно-доминантному типу. Это означает, что при выявлении синдрома Клиппеля-Треноне вероятность диагностирования дефекта у ребенка составляет 50%. Известны также случаи наследования болезни через поколение. К возникновению генетического дефекта предрасполагает воздействие на будущую мать следующих неблагоприятных факторов:
- Хронические сильные стрессы и тревожность – распространенная причина пороков развития у детей. Их влияние особенно опасно в первом триместре беременности.
- Употребление лекарственных средств. Ряд препаратов обладает тератогенным действием, то есть способностью приводить к формированию уродств у плода.
- Инфекционные заболевания у матери в период вынашивания малыша. Бактериальные и вирусные агенты могут нарушать процесс нормального развития ребенка и способствовать возникновению различных дефектов.
- Употребление алкоголя, наркотических средств и курение во время беременности или незадолго до нее. Вредные привычки приводят к интоксикации организма женщины. Соединения, поступающие в кровь в результате метаболизма спирта и других веществ, проникают через плаценту, оказывая негативное воздействие на плод.
Характерные симптомы
Клиническая картина патологии специфична, поэтому диагностика в большинстве случаев не вызывает затруднений. Отмечено, что синдром Клиппеля-Треноне у новорожденных практически не диагностируется. Симптомы заболевания проявляются в течение первых месяцев или лет жизни. При этом патология склонна к прогрессированию, особенно при отсутствии адекватного лечения. Характерные клинические признаки включают в себя следующее:
- Значительное расширение вен нижних конечностей – варикоз. Из-за этого на ногах появляется специфический рисунок. Сосуды расширены, значительно выступают и хорошо видны под кожей.
- На фоне нарушения циркуляции крови отмечается развитие отечности. Изменение нормальной гемодинамики приводит и к другим проблемам. Пораженная конечность зачастую увеличена в длине и объеме, поскольку в патологический процесс вовлечены не только мягкие ткани, но и кости.
- На коже появляется характерная пигментация – «винные пятна», фото которых представлено ниже. Они формируются в результате повреждения кровеносного русла и, по сути, представляют собой петехии и гематомы.
- При высокой выраженности варикозного расширения вен формируются трофические язвы. Они образуются вследствие нарушения нормального питания отдельных участков кожи, жировой клетчатки и мышечных волокон. Раны не затягиваются в течение длительного времени, что значительно снижает качество жизни пациента.
- У некоторых новорожденных с синдромом Клиппеля-Треноне-Вебера отмечается наличие сросшихся пальцев на руках и ногах, а также увеличение их количества – полидактилия.
 Симптом «винные пятна»
Симптом «винные пятна»
В ряде случаев возникновение заболевания ассоциировано с менее характерными признаками, поражающими различные органы:
- Патология способна негативно влиять на работу желудочно-кишечного тракта. Специфические симптомы, кроме диспепсических явлений, включают в себя развитие кровотечений в различных отделах пищеварительной системы. При этом интенсивность гемодинамических нарушений значительно варьируется. Может отмечаться лишь примесь эритроцитов в стуле, однако некоторые пациенты страдают от жизнеугрожающей потери крови. Чаще всего повреждается пищевод, а также толстый отдел кишечника.
- В патологический процесс вовлекается и селезенка. При формировании синдрома Клиппеля-Треноне характерно образование гемангиом.
- Развитие симптомов со стороны мочеполовой системы указывает на неблагоприятный прогноз недуга, так как свидетельствует о наличии серьезных нарушений в работе организма. У пациентов в моче присутствует кровь, отмечается значительное увеличение почек в размерах.
- Проявления со стороны опорно-двигательного аппарата больше распространены. Они диагностируются прежде всего в периферическом скелете. Происходит изменение строения конечностей, что связано с их неадекватным кровоснабжением. К числу редких симптомов относят искривления позвоночного столба, макроцефалию и формирование аневризм.
Постановка диагноза
Подтвердить проблему врачам зачастую удается уже во время первичного осмотра. Патология имеет характерные клинические проявления. На генетическую проблему указывает и анамнез, отягощенный случаями выявления дефекта у родственников пациента. В ходе диагностики применяются визуальные методы – УЗИ с использованием допплера, а также рентген с контрастированием и магнитно-резонансная томография. В ходе этих исследований отмечаются специфические изменения сосудистого русла.
Выявляются также завихрения потоков крови и формирование анастомозов. Для оценки функции почек, печени и ЖКТ осуществляются гематологические тесты. Они необходимы, поскольку недуг может поражать вены внутренних органов. Лабораторные исследования применяются и при подготовке к оперативному вмешательству. Анализы крови используются с целью оценки анестезиологических рисков.
Поставить диагноз до рождения ребенка не удается. Все имеющиеся методы используются только после появления симптомов заболевания.

Лечение
Медицина успешно борется с васкулярными поражениями. Тактика борьбы с недугом определяется исходя из выраженности патологических изменений. На сегодняшний день лечение синдрома Клиппеля-Треноне проводится не только в клиниках Германии, Швеции и Италии, но и в России. Это возможно, благодаря достижениям в сфере медицинского оборудования. Консервативная терапия практически не приносит результата и используется лишь в качестве поддерживающей. Патологию успешно лечат при помощи различных хирургических техник:
- При сужении просвета сосуда выполняется его стентирование. Эта операция восстанавливает нормальную циркуляцию крови по вене и препятствует ее дальнейшему спадению.
- В ряде случаев пациентам требуется шунтирование. Данная процедура заключается в создании своеобразного пути обхода поврежденного участка сосудистого русла. К этой технике прибегают при выраженных дефектах.
- Для лечения синдрома Клиппеля-Треноне-Вебера широко применяются лазеры. Выполняемая с их помощью коагуляция вен малотравматична и помогает успешно бороться с варикозом.
В большинстве случаев даже после проведения хирургического лечения требуется регулярный контроль состояния здоровья пациента, а также соблюдение ряда ограничений. Больным не рекомендуются физические упражнения, поднятие тяжестей. Такие нагрузки плохо сказываются на состоянии сосудов. Обязательным условием длительного сохранения лечебного эффекта после осуществления операции является ношение компрессионного трикотажа.
В ряде случаев требуется использование медикаментов, например, антикоагулянтов, снижающих риск образования тромбов и развития тяжелых осложнений. Прогноз при заболевании зависит как от степени выраженности патологических изменений, так и от своевременности оказания медицинской помощи.
Профилактика
Для предотвращения развития синдрома Клиппеля-Треноне врачи рекомендуют будущим родителям, чей семейный анамнез осложнен случаями выявления патологии, проходить генетическое обследование. Женщинам в период беременности следует избегать стрессов, употребления сильнодействующих препаратов, а также сбалансированно питаться и проводить много времени на свежем воздухе. Для предотвращения развития осложнений, включающих в себя тромбоэмболию и язвенные поражения, при появлении симптомов необходимо обратиться к врачу.
Отзывы о лечении
Олег, 27 лет, г. Калининград
У меня врожденное заболевание сосудов – синдром Клиппеля-Треноне. Из-за этого левая нога немного больше правой, на ней вздуваются вены, периодически появляются крупные синяки. Врачи уже делали несколько операций, чтобы восстановить нормальное кровообращение. Сейчас нога выглядит намного лучше. Приходится постоянно носить компрессионное белье, иначе появляются отеки и боль.
Анна, 32 года, г. Иркутск
Через некоторое время после рождения дочки врачи выявили у нее синдром Клиппеля-Треноне. От этого заболевания страдала моя мама, видимо, девочке проблема передалась через поколение. Варикоз выражен несильно, да и ножка не очень отекает. Дочери провели удаление поврежденных сосудов. После операции она принимает антикоагулянты, носит специальные колготки.
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.


Читайте в новом номере
Синдром Клиппеля – Треноне – Вебера – Рубашова (СКТВР) — врожденная ангиодисплазия периферических сосудов с формированием патологических артериовенозных соустий, наличие которых обусловливает нарушение кровотока по магистральным венам пораженной конечности с развитием варикозной трансформации поверхностных вен. Для синдрома характерно разнообразие клинических проявлений, поэтому лечение требует мультидисциплинарного подхода. Лечение заболевания — хирургическое, зачастую с большим количеством осложнений. В подавляющем большинстве случаев применяется поэтапное хирургическое лечение, травматичное и приводящее к большому количеству осложнений (кровотечения, трофические язвы, гипертрофические и келлоидные рубцы). Частота послеоперационных рецидивов достигает 30–48%. В статье представлен клинический случай хронического абсцесса легких у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова. Приведенный клинический случай является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого. Пациенты с СКТВР редко попадают в поле зрения врача-пульмонолога или торакального хирурга, а приведенный клинический случай является наглядной иллюстрацией возможного легочного проявления врожденной ангиодисплазии.
Ключевые слова: синдром Клиппеля – Треноне – Вебера – Рубашова, абсцесс легкого, клинический случай.
Для цитирования: Скорняков С.Н., Сабадаш Е.В., Медвинский И.Д., Бердников Р.Б., Хольный П.М., Дьячков И.А., Николаева М.О., Щиголев М.И., Масютина Д.Д., Иванчикова Е.Д. Хронический абсцесс легкого у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова // РМЖ. 2018. №3(I). С. 36-39
The chronic lung abscess in a patient with Klippel – Trenaunay – Weber Syndrome
Skornyakov S.N. 1,2 , Sabadash Е.V. 1,2 , Medvinsky I.D. 1,2 , Berdnikov R.B. 1,2 , Holny P.M. 2 , Dyachkov I.A. 1,2 , Nikolaeva M.O. 1 ,ShchigolevM.I. 1 , Masyutina D.D. 1 , Ivanchikova E.D. 1
1 Ural State Medical University, Yekaterinburg
2 Ural research Institute of Phthisiopulmonology, Yekaterinburg
Klippel – Trenaunay – Weber (KTW) syndrome is a congenital angiodysplasia of peripheral vessels with the formation of pathological arteriovenous communications, the presence of which causes the violation of blood flow along the main veins of the affected limb with the development of varicose transformation of superficial veins of the extremities. The syndrome is characterized by a variety of clinical manifestations, so treatment requires a multidisciplinary approach. The disease needs surgical treatment, often with a large number of complications. In the vast majority of cases, staged surgical treatment is used, it is often traumatic and leads to a large number of complications (bleeding, trophic ulcers, hypertrophic and keloid scars). The frequency of postoperative relapse reaches 30–48%. The article presents a clinical case of chronic lung abscess in a patient with Klippel-Trenaunay-Weber syndrome. The presented clinical case is a unique example of the combination of the syndrome of congenital angiodysplasia and chronic lung abscess. Patients with KTW syndrome rarely come into the view of a pulmonologist or thoracic surgeon, and this clinical case is a clear illustration of the possible pulmonary manifestation of congenital angiodysplasia.
Key words: Klippel – Trenaunay – Weber syndrome, lung abscess, clinical case.
For citation: Skornyakov S.N., Sabadash Е.V., Medvinsky I.D. et al. The chronic lung abscess in a patient with Klippel – Trenaunay – Weber Syndrome // RMJ. 2018. № 3(I). P. 36–39.
В статье представлен клинический случай хронического абсцесса легких у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова, который является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого.
Введение
Клинический случай
В туберкулезное легочно-хирургическое отделение Уральского научно-исследовательского института фтизиопульмонологии 17 апреля 2017 г. поступил пациент П., 46 лет, с жалобами на периодический кашель с выделением светлой мокроты, одышку при умеренной физической нагрузке (вынужденная остановка при ходьбе на 2–3-лестничном пролете), множественные телеангиоэктазии латеральной, задней шейных, дельтовидной, грудной, локтевой областей слева.
История болезни.
В 2003 г. при прохождении обследования (подготовка к плановому оперативному лечению по поводу СКТВР) по результатам обзорной рентгенографии органов грудной клетки (ОГК) впервые диагностирован поликистоз нижней доли левого легкого. За медицинской помощью пациент не обращался. В октябре 2016 г. заболел остро, когда на фоне фебрильной лихорадки появился продуктивный кашель с отделением небольшого количества гнойной мокроты с геморрагическим компонентом (прожилки крови). В последующие дни стал отмечать усиление кашля по ночам при положении на правом боку. Выраженность кашлевого синдрома значительно снижалась при положении на левом боку и в дневное время суток. Самостоятельно не лечился, за медицинской помощью по-прежнему не обращался. В ноябре 2016 г. отметил некоторое улучшение в виде урежения ночных приступов кашля. В январе 2017 г. состояние вновь ухудшилось, появились выраженная общая слабость, снижение толерантности к физическим нагрузкам, кровохарканье. После обращения за медицинской помощью был обследован. По данным мультиспиральной компьютерной томографии (КТ) ОГК и КТ с внутривенным контрастным усилением диагностировано разрушенное левое легкое на фоне поликистозного поражения. Рекомендовано плановое оперативное лечение в объеме пульмонэктомии слева.
В анамнезе. В детстве на фоне интенсивных физических нагрузок (занимался спортивной греблей) было отмечено появление и медленное прогрессирование следующих симптомов: нарушение местной терморегуляции, периодические ноющие боли и варикозная деформация поверхностных вен левой верхней конечности (рис. 1). Диагностирована врожденная ангиодисплазия. После отказа от занятий спортом прогрессирование клинических проявлений заболевания замедлилось. В 2003 г. по поводу СКТВР было выполнено разобщение артериовенозных соустий левой верхней конечности. Впоследствии и по настоящее время синдром проявляется в виде редких эпизодов спонтанно возникающих непродолжительных ноющих болей в левой верхней конечности, особенно в указательном пальце, продолжительностью около 10 мин. Продолжительность периодов бессимптомного течения может достигать нескольких месяцев, чаще 4–6 нед. 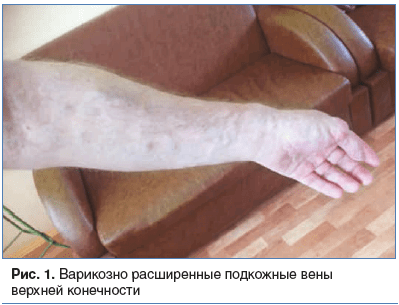
Прочие сопутствующие заболевания. С детства отмечает частые острые респираторные вирусные инфекции, бронхиты. Гипертоническая болезнь II стадии.
Семейный анамнез отягощен по заболеваниям сердечно-сосудистой системы.
При поступлении: общее состояние удовлетворительное. Телосложение гиперстеническое. Кожные покровы физиологической окраски. На коже левых латеральной, задней шейных областей располагается телеангиоэктатический сосудистый невус («винный» невус) неправильной формы, 4–6 см в диаметре, не возвышающийся над поверхностью кожи, а также множественные телеангиоэктазии дельтовидной, частично грудной и локтевой областей слева (рис. 2). Щитовидная железа не увеличена. Дыхание через нос свободное. Грудная клетка правильной формы. Обе половины ее одинаково участвуют в акте дыхания. Перкуторно над легкими справа: ясный легочной звук, слева: в верхних отделах коробочный, в нижних — тимпанит. В правом легком дыхание везикулярное, в левом выслушиваются разнокалиберные влажные хрипы. ЧДД — 16 в минуту. Границы сердца не смещены, не расширены. Тоны сердца ясные, ритм правильный, шумы отсутствуют. ЧСС — 89 в минуту, АД — 125/80 мм рт. ст. Пульс — 89 уд/мин, ритмичный, нормального наполнения и напряжения. Живот правильной формы, пальпаторно мягкий, безболезненный во всех отделах. Нижний край печени выше края реберной дуги. Поясничные области визуально и пальпаторно не изменены. Симптомы поколачивания отрицательные с обеих сторон. Дизурии нет. Очаговой неврологической симптоматики нет. 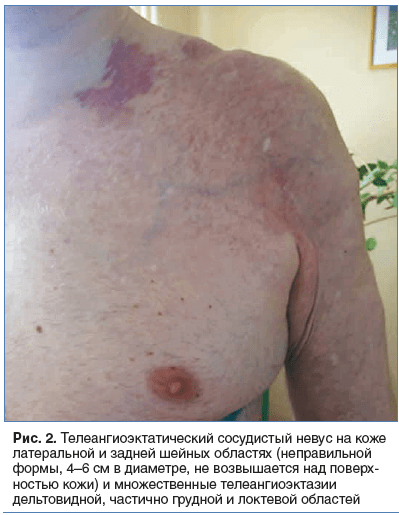
При обследовании: в общем анализе крови: лейкоциты — 9,8×10 9 /л, эритроциты — 5,55×10 12 /л, тромбоциты — 263×10 9 /л, гемоглобин — 143 г/л, гематокрит 43,1%, СОЭ —13 мм/ч. Общий анализ мочи: удельный вес — 1,030 г/л, рН — 5,0, уробилиноген — 3 мг/дл. Биохимия крови: глюкоза — 4,5 ммоль/л, общий белок — 73,4 г/л, альбумин — 39,6 г/л, АСТ — 19,0 Ед/л, АЛТ — 55,8 Ед/л, мочевина — 7,2 ммоль/л. Коагулограмма: тромбоциты — 450×10 9 /л, активированное частичное тромбопластиновое время — 29,2 с, протромбиновое время — 13,3 с, международное нормализованное отношение — 1,26 (удлинение коагуляции по внешнему пути).
ФГДС: варикозно расширенные вены нижней трети пищевода II–III степени. ЭКГ: синусовая тахикардия до 90 уд/мин. Метаболические нарушения, неполная блокада правой ножки пучка Гиса. Дуплексное сканирование вен верхних конечностей с цветным картированием: поверхностные и глубокие вены правой верхней конечности проходимы. Посттромботическая болезнь левой верхней конечности, реканализация срединной подкожной вены, частичная реканализация латеральной подкожной вены в области локтевого сгиба, без флотации. Варикозная трансформация латеральной подкожной, срединной подкожной, лучевой, локтевой вен слева. КТ ОГК с внутривенным контрастным усилением: в паренхиме правого легкого очаговых и фокусных изменений нет. В левом легком во всех сегментах, преимущественно в нижней доле, определяются множественные крупные и средних размеров округлые полости (кисты, буллы), разделенные тонкими септами. Некоторые полости (в задних и нижних отделах) с жидкостью, дренируются соответствующими бронхами. Артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной. Оставшаяся паренхима избыточно воздушна, сосудистый рисунок обеднен. Свободного выпота в плевральных полостях нет. Ствол легочной артерии не расширен. Костные элементы и мягкие ткани грудной стенки не изменены. Заключение: кистозно-буллезная трансформация паренхимы левого легкого (рис. 3). 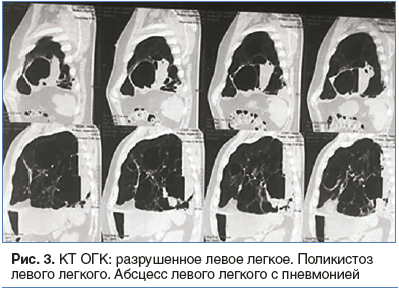
Осмотр офтальмолога: пигментный невус сетчатки левого глаза.
Предоперационный диагноз: разрушенное левое легкое. Поликистоз левого легкого (?). Абсцесс левого легкого с пневмонией (?).
15.05.17 пациенту была выполнена пульмонэктомия слева.
Интраоперационно: плевральная полость свободна, грубые рубцовые сращения в задних отделах и над диафрагмой. Легкое выделено из сращений остро-тупо. Легкое практически полностью выполнено кистами: воздушными и наполненными (напряженными). Элементы корня легкого обработаны раздельно: поочередно перевязаны и дважды прошиты легочная артерия, верхняя и нижняя легочные вены (DSTSeries™ TA™, typeTA30V3S, Covidien, NewHaven, CT, USA, 6 шт.). Культя главного бронха мобилизована до бифуркации, произведена ее реампутация на уровне 2–3-го полукольца. Культя ушита вручную узловыми швами атравматично проленом 3/0 по Суиту с шагом 1–1,5 мм. Дренаж. Послойные швы.
Послеоперационный период протекал гладко. Проведен курс антибактериальной профилактики гнойных осложнений. По дренажам из плевральной полости в 1-е сутки после операции выделилось 250 мл серозно-геморрагической жидкости, в течение 2-х дней после операции количество отделяемого в сутки уменьшилось до 100 мл, сброса воздуха по плевральному дренажу и явлений подкожной эмфиземы не отмечалось. На 3-и сутки после операции дренаж удален с подпусканием воздуха в плевральную полость. Операционная рана зажила первичным натяжением.
Патогистологическое исследование № 459/17. Практически всю нижнюю долю занимает гигантская полость многокамерного строения, с кожистой стенкой, заполненная большим количеством зеленоватых масс. Стенка полости 3-слойная: гнойно-некротический слой с большим количеством нейтрофилов, слой грануляционной ткани неспецифического вида, широкий фиброзный слой. Вокруг большое количество гемосидерофагов интраальвеолярно, участки организации, бронхоэктазы. В легочной ткани также определяются гемосидерофаги интраальвеолярно, имеется утолщение и перекалибровка сосудов с резким утолщением их стенки и сужением просвета. По линии резекции — склероз стенки бронха. Окраска по Цилю — Нильсену отрицательная.
Заключение: гигантский многокамерный хронический абсцесс в нижней доле левого легкого в активной фазе гнойного воспаления. Гемосидероз легкого (кровохарканье в анамнезе) (рис. 4). 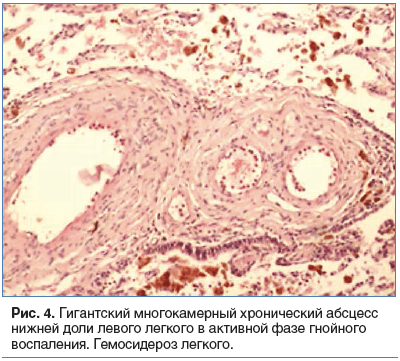
При контрольном осмотре через 1 мес.: жалобы на умеренные боли в области торакотомного разреза (рубец без признаков воспаления), температура тела в норме. Обзорная рентгенография ОГК: слева — остаточная полость частично заполнилась гомогенным содержимым. Других дополнительных затемнений и уровней жидкости нет; справа — очаговых и фокусных изменений нет.
Через 6 мес. после оперативного вмешательства состояние удовлетворительное, никаких жалоб пациент не предъявляет. При рентгенографии ОГК: слева — остаточная полость полностью заполнилась гомогенным содержимым, справа — очаговых и фокусных изменений нет.
Заключение
Только для зарегистрированных пользователей